OBJETIVO:
a) Investigar el poder reductor de cuatro compuestos carbonílicos frente a oxidantes suaves.
b) Comparar el poder reductor de la sacarosa con el de los productos de su hidrólisis
Conceptos:
- Poder reductor: Capacidad de una sustancia de oxidarse(tener una pérdida aparente de electrones) para posibilitar la reducción(adquicision de electrones) de otra en un proceso REDOX (proceso donde una sustancia se reduce disminuye su estado de oxidación y otra se oxida aumenta su estado de oxidación)
- Compuesto carbonílico: sustancias quimicas que tienen la siguiente estructura siendo A y B grupos funcionales cualquesquiera
- Oxidante suave: posibilita una oxidación en la que el esqueleto de atomos de C de la sustancia que se oxida no se modifica
- Hidrólisis: es una reacción química entre una molécula de agua y otra molécula, en la cual la molécula de agua se divide y sus átomos pasan a formar parte de otra especie química La hidrólisis ácido‑base se produce al disolver determinadas sales en agua. La reacción tiene lugar entre uno de los iones de la sal y el agua y, hay que tener en cuenta que se trata de una reacción de equilibrio
MATERIALES Y SUSTANCIAS
- Vaso de bohemia
- Soporte y tela metálica
- Tubos de ensayo
- Varilla de vidrio
- Pinza para tubos
- Mechero
- Metanal (formol)
- Propanona
- Glucosa
- Fructosa
- Sacarosa
- Nitrato de Plata (AgNO3)
- Hidróxido de sodio (HCl)
- Amoniaco
- Fehling A
- Fehling B
OBJETIVO A:
Parte 1: Con reactivo de Fehling
- Fehling: Es una solución que descubrió el alemán Hermann Von Fehling y se caracteriza fundamentalmente por su utilización como reactivo para la determinación de azúcares reductores es decir demostrar la presencia de glucosa o sus derivados como la sacarosa o la fructosa, también se lo conoce como licor de Fehling. Su acción se fundamenta en el poder reductor del grupo carbonilo de los aldehídos el cual se oxida a ácido y se reduce la sal de cobre en medio alcalino a óxido de cobre, formando un precipitado de color rojo. El reactivo de Fehling se fundamenta principalmente, en su reacción, la oxidación de cobre, el poder reductor de los azúcares, sea este en monosacáridos, polisacáridos, aldehídos, y en ciertas cetonas. Agregando un aldehído y calentando suavemente, el color azul desaparece y aparece un precipitado rojo de óxido cuproso (Cu2O).
La reacción, en forma simplificada, puede representarse así:
R - C = O + 2Cu2- + 5 OH ------------ R - C = O + Cu2O + 3 H2O
1) Coloque 0,5ml (10 gotas aprox) de solución acuosa CuSO4 (Fehling A) en un tubo de ensayo
R - C = O + 2Cu2- + 5 OH ------------ R - C = O + Cu2O + 3 H2O
2) Agregue igual volumen de solución acuosa de tartrato de sodio y potasio en medio básico (Fehling B). Agite. Debe obtenerse una solución azul intensa como se muestra abajo
- NOTA: Felhing A y B deben ser mezclados en el momento de la práctica, ya que no se preservan si se guardan juntos, precipitan a hidróxido de cobre.
3) Caliente hasta ebullición tomando las precauciones correspondientes. El color azul debe persistir tras el calentamiento; si esto no ocurre significa que en el tubo hay reductores presentes, por lo que deseche el reactivo y repita el procedimento con un tubo limpio.
4) Agregue 1ml de metanal y caliente con cuidado para evitar proyecciones.
5) Observe y anote los cambios (en tabla adjunta abajo).
6) Repita hasta el paso 3 y en paso 4 cambiar 1ml de metanal por: 1ml de acetona, luego 1ml de glucosa, 1ml de fructosa, 1ml lactosa en instancias diferentes y observar la reaccion de los mismos frente a este reactivo.
Acetona con Fehling
Glucosa con Fehling
Parte 2: Con reactivo Tollens
- Tollens: El complejo diamina-plata(I) es un agente oxidante, reduciéndose a plata metálico, que en un vaso de reacción limpio, forma un "espejo de plata". Éste es usado para verificar la presencia de aldehídos, que son oxidados a ácidos carboxílicos.
1) En un tubo de ensayo coloque 1ml de solución AgNO3.
2) Agregue una gota de solución de NaOH. Se formará un precipitado pardo.
3) Agregue NH3 gota a gota hasta la disolución del precipitado, a nosotras nos llevó 4 gotas.
4) Agregue 1ml de metanal y caliente suavemente sin agitar moviendo el tubo circularmente alrededor de la llama.
5) Observe y anote los cambios (en cuadro abajo).
6) Repita el procedimiento con acetona, glucosa, fructosa, lactosa, productos de hidrólisis de sacarosa.
(TENER EN CUENTA EL EROOR COMETIDO AL AGITAR EL PREPARADO EN VEZ DE DAR VUELTAS CON EL ALREDEDOR DEL MECHERO)
Resultado positivo de Tollens. Sustancia algo espesa color plata
OBJETIVO B:
1) Realizar parte 1 para 1ml de sacarosa diluido en agua.
2) Observe comportamiento (anotado en cuadro abajo).
3) Coloque en un tubo de ensayo 2ml de solución de sacarosa.
4) Agregue 2 gotas de HCl concentrado.
*de esta manera queda una sal formada por la sacarosa(base) y HCl(ácido) cuyas moléculas interactuan con las del agua resultando en una nueva sustancia: HIDROLISIS
5) Coloque el tubo en baño de agua en ebullición durante 5 minutos.
6) Divida el contenido en 2 tubos y realice con cada muestra los ensayos de Fehling y Tollens (anotamos observaciones en el cuadro).
7) Comparamos los resultados con los de la sacarosa sin hidrolizar (debajo de la tabla).
Sustancia
|
Con Fehling
|
Con Tollens
|
Metanal
|
Rojo sólido
|
Espejo de plata
|
Acetona
|
Líquido azul
|
Transparente
|
Glucosa
|
Líquido rojo
|
Espejo de plata
|
Fructosa
|
Líquido rojo amarronado
|
Espejo de plata
|
Sacarosa
|
Líquido de azul
|
Transparente
|
Productos de hidrólisis
|
Líquido naranja
|
Espejo de plata
|
Lactosa
|
Líquido rojo ladrillo
|
Espejo de plata
|
SACAROSA SIN HIDROLIZAR CON FEHLING
A la izquierda se ve la solucion de sacarosa, a la derecha su reaccion con fehling
SACAROSA HIDROLIZADA CON FEHLING
OBSERVACIONES:
1. Toda sustancia cuya reaccion con el reactivo Fehling da positiva, también da positiva con Tollens dado que ambos reactivos indican si la sustancia puesta a reaccionar tiene glucidos reductores.
2. Discutiendo los resultados positivos, que se dio en la glucosa, fructosa, metanal, lactosa este reactivo, reacciona principalmente con los aldehídos porque tienen un grupo carbonilo más expuesto, que le da el carácter reductor, y existe la presencia del precipitado rojo ladrillo (óxido cuproso).

Fructos tiene un carbonilo secundario..¿porque da positivo?
En la fructosa ocurre un fenomeno llamado tautomeria en el cual los atomos de una misma molecula se reacomodan. Los dos compuestos generados por la tautomeria en la glucosa son acido glutamico y manoico, ambos con poder reductor al poder perder el H de su grupo carboxilo.
3. La acetona por otra parte dio negativo con ambos reactivos, lo que nos dice que no es un glicido reductor. Esto se puede explicar viendo si estructura
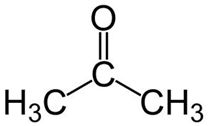
En quimica organica simepre lo que cambia es un grupo funcional, en este caso lo que deberia poder oxidarse para darle un poder reductor a la acetona es el grupo carbonilo secundario lo que no es posible con un oxidante suave dado que el C secundario esta unido a un O y a dos C. Para roper el esqueleto carbonado para oxidar la acetona se debe usar un oxidante fuerte por la fuerza de los enlaces C-C
4. La sacarosa (que no nos dió coloración), esto se da porque es un azúcar constituida por una molécula de glucosa y de fructosa, tiene un enlace entre el primer carbono de la glucosa y el segundo carbono de la fructosa, y no queda grupos reductores disponibles.


La sacarosa a diferencia de la gran mayoria de los disacaridos, como la lactosa, que dio positiva con los reactivos trabajados; sus componentes o monosacaridos que lo integran están unidos de por un enlace llamado alfa 1-beta-2 glicosidrico, en el que los carbonos anoméricos los que en cualquier otro disacarido quedarian libres y expuestos posibilitando la reduccion del glícido, se unen resultando que no queden C libres que puedan recibir mas O imposibilitando que la sacarosa actue como agente reductor(quien se oxida para posibilitar la reduccion de otra especie química)
5. La sacarosa hidrolizada se convierte en dos compuestos: Fructosa y Glucosa, ambos carbohidratos con un carbono anomerico libre para recibir O, por tanto reductores, felhing y tollens dan positivo.










No hay comentarios:
Publicar un comentario